#meristemoid
Text
Following amplifying divisions of the meristemoid, the resulting SLGCs can differentiate into pavement cells, which are the most abundant cell type in the epidermis of a mature leaf, or they can divide asymmetrically (spacing divisions) to give rise to a secondary meristemoid.
"Plant Physiology and Development" int'l 6e - Taiz, L., Zeiger, E., Møller, I.M., Murphy, A.
#book quote#plant physiology and development#nonfiction#textbook#meristemoid#slgc#stomatal lineage ground cell#plant cells#cell division#epidermis#pavement cells
0 notes
Text
For example, ERECTA, which is expressed strongly in the protodermal cells but is undetectable thereafter, restricts asymmetric entry division in MMCs (Figure 19.11). (...) As a result, the ERECTA receptor inhibits stomatal development (see Figure 19.11).


"Plant Physiology and Development" int'l 6e - Taiz, L., Zeiger, E., Møller, I.M., Murphy, A.
#book quotes#plant physiology and development#nonfiction#textbook#erecta#plant cells#protodermal cells#mmc#meristemoid mother cells#stomata
0 notes
Link
Aplikasi teknik kultur jaringan bertujuan untuk eliminasi suatu penyakit atau produksi bibit bebas penyakit, kelestarian plasma nutfah, sehingga dapat menghasilkan varietas unggul dan produksi senyawa metabolite sekunder. Oleh karena itu teknik kultur jaingan ini sangat penting diterapkan dalam perbanyakan tanaman baik untuk tanaman pertanian maupun tanaman perkebunan (Basri.,2016).
Selain untuk perbanyakan tanaman kulturin vitro juga telah digunakan untuk menghasilkan bibit vanili yang bebas penyakit. Penggunaan kultivar vanili yang tahan penyakit busuk batang dengan hasil tinggi diharapkan menjadi alternative untuk pengendalian penyakit yang sangat sering terjadi tersebut. Planlet vanili yang tahan terhadap infeksi penyakit busuk batang dapat diinisiasi dan di seleksi secara in vitro pada media MS (Nurcahyani.,2013).
Kultur jaringan merupakan salah satu teknik dalam perbanyakan tanaman secara klonal untuk perbanyakan masal. Teknik kultur jaringan ini juga merupakan salah satu teknik perbanyakan bagian tanaman berupa sel, jaringan ataupun organ dalam keadaan aseptik secara in vitro dengan menggunakan media buatan yang mengandung nutrisi lengkap, zat pengatur tumbuh (ZPT) serta ruang kultur, suhu dan pencahayaan yang terkontrol (Lestari,2011).
Kultur In vitro dapat dilakukan melalui jalur organogenesis dan embryogenesis somatic. Organogenesis merupakan proses pembentukan dan perkembangan tunas dan jaringan meristem. Proses organogenesis dimulai dengan perubahan sel parenkim tunggal atau sekelompok kecil sel, dimana selanjutnya membelah menghasilkan suatu masa sel globuler atau meristemoid yang bersifat kenyal dan berkembang menjadi primordium pucuk dan akar. Kejadian ini dapat terjadi langsung pada eksplan atau tidak langsung melalui pembentukan kalus (Ratnawati,2018).
Proses dalam inisiasi terbagi menjadi 3 tahap :
ü Prosedur Sterilisasi Luar
· Eksplan di cuci pada air mengalir selama 1 jam
· Timbang fungisida, bakterisida dan detergen masing-masing 1 gram dalam 100 ml air.
· Eksplan dicuci dengan detergen selama 10 menit, kemudian dibilas pada air mengalir hingga tidak terdapat busa pada eksplan.
· Eksplan dicuci dengan fungisida dan bakterisida selama 1 jam, kemudian dibilas menggunakan air steril.
· Masukan eksplan kedalam larutan antibiotik dengan konsentrasi antibiotik 10% atau 10 ml antibiotik per 90 ml air selama 1 jam dengan di beri aerator agar eksplan tetap hidup.
ü Prosedur Sterilisasi dalam dan Inokulasi
· Siapkan alat dan bahan
· Masukan alat dan bahan ke dalam laminar dan nyalakan lampu serta blower
· Eksplan dibilas dengan air steril, kocok selama 3 menit.
· Eksplan dimasukkan kedalam HgCl 100 mg/100 ml, kemudian kocok selama 7 menit.
· sEksplan kemudian dibilas kembali dengan air steril dan dikocok selama 3 menit.
· Eksplan dimasukkan kedalam bayclin konsentrasi 15% selama 7 menit, bayclin 10% selama 7 menit, 5% bayclin 7 menit dengan ketentuan harus selalu dikocok.
· Eksplan kemudian dicuci kembali dengan air steril dan dikocok selama 3 menit dengan pengulangan sebanyak 4 kali, kemudian eksplan dipindahkan kedalam cawan petri.
· Masukkan pinset kedalam alkohol, kemudian bakar pinset pada api Bunsen, lalu di celupkan kedalam air steril.
· Ambil botol berisi media, kemudian keluarkan air yang mungkin terdapat dalam botol diatas tisu, kemudian bakar mulut botol media pada api Bunsen.
· Ambil pinset dan buka cawan petri untuk mengambil eksplan, kemudian tanam eksplan pada media.
· Bakar kembali mulut botol, kemudian tutup kembali dengan plastik dan karet hingga benar-benar kencang, lakukan hingga semua eksplan tertanam.
· Bereskan semua botol yang telah dipakai, kemudian keluarkan botol media yang telah berisi tanaman dari laminar.
· Botol media berisi eksplan diberi alumunium foil, kemudian ditutup dengan plastik dan diikat dengan karet 3-5 lilitan.
· Kemudian di lapisi dengan plastik wrap dan diberi label dengan keterangan nama eksplan, tanggal inisiasi, media yang digunakan dan nama penanam.
· Simpan semua botol media yang berisi eksplan di ruang inkubasi dengan suhu yang telah ditentukan.
Subkultur
· Rendam botol yang berisi planlet pada alkohol bekas
· Semprot bagian dalam enkas dengan alkohol 70%, lap menggunakan tisu yang telah di semprotkan alkohol.
· Masukkan semua alat dan bahan dengan menyemprot setiap alat dan bahan yang akan masuk kedalam enkas.
· Semprot tangan sebelum masuk kedalam enkas, kemudian susun setiap alat dan bahan yang berada dalam enkas sesuai dengan posisinya.
· Buka scapel dan pinset kemudian letakkan di dalam botol berisi alkohol 70%.
· Diamkan enkas selama kurang lebih 1 jam sebelum melakukan subkultur.
· Setelah satu jam, tangan disemprot dengan alkohol 70% sebelum masuk.
· Buka air steril dan tuangkan ke dalam cawan petri dan tutup botol selai, kemudian tambahkan betadhine.
· Buka botol planlet, kemudian ambil planlet dengan pinset dan letakkan diatas cawan petri.
· Potong planlet menggunakan scapel dengan ukuran 1-2 cm.
· Siapkan botol media untuk subkultur, buka penutupnya dan kemudian tanam dengan menggunakan pinset.
· Lap mulut botol dengan menggunakan kapas yang telah direndam betadhine.
· Tutup kembali botol yang berisi tanaman yang telah di subkultur.
· Setelah semua tanaman di subkultur, kemudian keluarkan semua alat dan bahan dari enkas, setelah itu enkas disemprot kembali dengan alkohol 70%
· Botol media yang berisi tanaman yang telah disubkultur kemudian ditutup dengan alumunium foil, plastik, karet dan wrapping. Kemudian diberi keterangan dengan nama jenis tanaman, tanggal penanaman, media yang digunakan serta nama penanam.
Aklimatisasi
· Siapkan planlet yang akan di aklimatisasi
· Timbang fungisida dan bakterisida masing-masing 1 gram, kemudian larutkan dalam 2 liter air.
· Keluarkan tanaman atau planlet dari botol kultur, kemudian rendam dalam air bersih dan bersihkan hingga bersih.
· Kemudian rendam planlet pada larutan fungisida dan bakterisida selama 15 menit
· Siapkan media berupa arang sekam dan cocopeat dengan perbandingan 1:1 sebagai media pertumbuhan
· Masukkan sterofoam ke dalam gelas plastik yang telah dilubangi, kemudian diisi dengan media yang telah dibuat, ratakan media dengan tangan.
· Angkat dan keringkan planlet pada Koran, tunggu hingga cukup kering.
· Tanam planlet pada media aklimatisasi, kemudian tutup bagian atas dengan menggunakan gelas plastik lainnya dan ditutup dengan menggunakan plastik wrap.
· Beri keterangan nama tanaman, tanggal dan nama penanam pada bagian botol tersebut.
0 notes
Photo

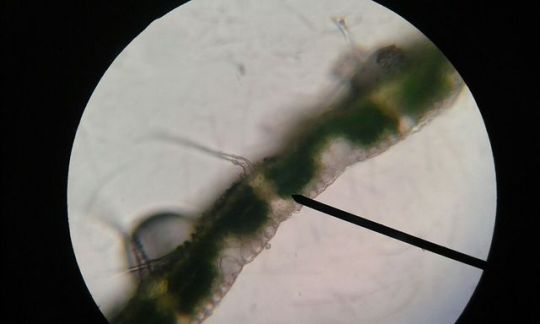

OBSERVACIÓN DE TRICOMAS
Los tricomas son apéndices epidérmicos con diversa forma, estructura y función. Su nombre proviene del griego trichos, que significa cabellera.
Origen: Los pelos se originan a partir de meristemoides epidérmicos. Se inician como una protuberancia que se agranda y puede o no dividirse
Estructura: Los tricomas presentan paredes celulósicas, recubiertas de cutícula, o paredes secundarias lignificadas. La cutícula puede ser lisa o esculturada. A veces las paredes están impregnadas de sílice o carbonato de calcio. El contenido citoplasmático varía con la función, en general están altamente vacuolados, pueden tener cristales o cistolitos. Frecuentemente los pelos unicelulares grandes tienen núcleos poliploides.
CLASIFICACIÓN
2. PELOS TECTORES: pelos no secretores, pueden estar compuestos de una o varias células
Pelos simples unicelulares. La porción que se inserta en la epidermis se llama pie, el resto es el cuerpo
Turnera panamensis:

Pelos simples pluricelulares: presentan una o varias filas de células

Pelos ramificados unicelulares:

Pelos ramificados pluricelulares.
Piriqueta: pelos estrellados y porrectoestrellados

Escamas o pelos peltado (tricomas escuamiformes)
Escamas de Tillandsia

Pelos glandulares o secretores: pueden ser unicelulares o pluricelulares muy complejos, generalmente tienen un pie y una cabeza secretora. En muchos tricomas secretores la cutícula se separa durante el proceso de secreción (e. pringamosa) Ver detalle de estos tricomas en el tema:
Pelargonium sp.

0 notes
Text
In Arabidopsis, guard cell differentiation also follows this trend, but is ultimately governed by the stomatal cell lineage (Figure 19.10). (...) Each MMC divides asymmetrically (the so-called entry division) to give rise to two morphologically distinct daughter cells – a larger stomatal lineage ground cell (SLGC) and a smaller meristemoid (see Figure 19.10). (...) Each of these transitions is associated with, and requires the specific expression of, one of three basic helix-loop-helix (bHLH) transcription factors: SPEECHLESS (SPCH), MUTE, and FAMA (named after the Roman goddess of rumor) (see Figure 19.10).

"Plant Physiology and Development" int'l 6e - Taiz, L., Zeiger, E., Møller, I.M., Murphy, A.
#book quotes#plant physiology and development#nonfiction#textbook#arabidopsis#guard cells#cell differentiation#stomata#mmc#meristemoid mother cell#slgc#stomatal lineage ground cell#cell division#daughter cells#bhlh#basic helix loop helix#transcription factor#spch#speechless#mute#fama
1 note
·
View note