Text
Lista de Exercícios N.° 2
Esta breve lista apresenta duas interessantes questões do ENEM 2021. No primeiro problema, são contemplados os temas estequiometria (especificamente, o caso de rendimentos menores do que 100%), fermentação e densidade e, no segundo, de forma en passant, acidez e basicidade, numa pergunta que testa, mais do que qualquer outra coisa, a interpretação crítica de um texto de cunho científico.

ENEM 2021 | A obtenção de etanol utilizando a cana-de-açúcar envolve a fermentação dos monossacarídeos formadores da sacarose contida no melaço. Um desses formadores é a glicose ( C₆H₁₂O₆ ), cuja fermentação produz cerca de 50 g de etanol a partir de 100 g de glicose, conforme a equação química descrita.

Em uma condição específica de fermentação, obtém-se 80% de conversão em etanol que, após sua purificação, apresenta densidade igual a 0,80 g/mL. O melaço utilizado apresentou 50 kg de monossacarídeos na forma de glicose.
O volume de etanol, em litro, obtido nesse processo é mais próximo de
a) 16.
b) 20.
c) 25
d) 64.
e) 100.
Resposta: alternativa c
Resolução
Trata-se de uma questão de resolução fundamentalmente simples, embora possa exigir uma leitura mais cuidadosa do que é o comum. Não é necessário preocupar-se com o balanceamento ou com quantidades de mol, mas sim considerar a relação glicose - etanol (100g para 50g) e o “pulo do gato” - a adoção da porcentagem 80% como sendo o rendimento do processo. Isso significa que, para uma reação em que seria esperado que a proporção entre reagente e produto fosse 100g para 50g, agora a quantidade de produto real obtida é somente 80%; trocando em miúdos, a nova relação vale 100g para 40g somente.
Estabelecida essa relação, pode-se montar uma proporção levando-a em conta:
100g ---------- 40g
50kg ---------- m
em que m é a massa de etanol, e 50kg, a quantidade real de glicose utilizada. A massa m, feito o cálculo, vale 20kg, ou 20000g. Essa é a quantidade de entanol obtida. Como, entretanto, o que se pede é seu volume, basta aplicar a esse resultado parcial a densidade da substância, fornecida no enunciado (0,8g/ml):
0,8g ------------ 1ml
20000g -------- V
V = 25000ml ou 25L
ENEM 2021 | O emprego de células de combustível a hidrogênio pode ser uma tecnologia adequada ao transporte automotivo. O quadro apresenta características de cinco tecnologias mais proeminentes de células de combustível.
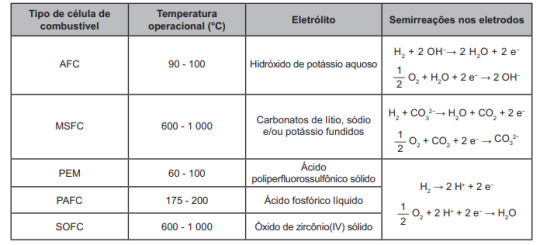
Testes operacionais com esses tipos de células têm indicado que as melhores alternativas para veículos são as que operam em baixos níveis de energia térmica, são formadas por membranas de eletrólitos poliméricos e ocorrem em meio ácido.
THOMAS, S; ZALBOWITZ. M. Full cells: green power. Los Alamos National Laboratory, Los Alamos, NM. 1999 (adaptado).
A tecnologia testada mais adequada para o emprego em veículos automotivos é a célula de combustível
a) AFC.
b) MSFC.
c) PEM.
d) PAFC.
e) SOFC.
Resposta: alternativa c
Resolução
Eis uma questão que não se aprofunda em conceitos químicos, mas não deixa de cobrá-los.
O quadro e o parágrafo que vem logo depois dele concentram as informações principais. “Baixos níveis de energia” devem ser traduzidos como baixas temperaturas; as duas últimas colunas da tabela explicitam se os meios são ácidos ou básicos; além disso, uma última informação é de capital importância: o prefixo “poli” em “ácido poliperfluorossulfônico”, que indica que tal ácido se apresenta na forma polimerizada, o que, segundo o enunciado, também é uma condição preferencial.
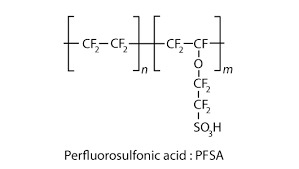
Em conjunto, essas conclusões levam à célula do tipo PEM.
#enem#vestibular#resolução#química#enem 2021#enem 2022#questão resolvida#ensino médio#polímero#ácido#célula a combustível#estequiometria#glicose#etanol#rendimento
0 notes
Photo

Tabela completa de solubilidade de substâncias iônicas em água, retirada do trabalho do Instituto de Química de São Carlos (USP), tendo como referência a obra de Brady, Russel e Holum.
0 notes
Link
Esse tema se origina de uma pergunta feita por uma aluna. O que é um fluido não-newtoniano e qual a relação dele com o conteúdo de Química?
Em primeiro lugar, a relação entre o assunto e nossa disciplina pode ser identificada durante o estudo dos coloides, que são um tipo de dispersão, categoria de mistura dentro da qual enquadram-se, também, as soluções.
O fato é que os coloides são misturas homogêneas quando encarados a olho nu, mas não o são realmente do ponto de vista microscópico. Neles, as partículas são maiores do que moléculas ou íons - enquadrando-se numa faixa de tamanho que vai de 1 a 1000 nanometros - o que confere características diferentes das verificadas nas soluções. Uma dessas possíveis facetas é o comportamento não-newtoniano.
Um fluido não-newtoniano, de uma maneira simples, é aquele que apresenta uma tendência de cisalhamento (que é, grosso modo, a possibilidade de imergir algum objeto) que não é proporcional ao seu escoamento. Em outras palavras, quando mergulhamos na água, ela se “divide” e escoa para os lados ao mesmo tempo em que tentamos “separá-la” ao entrarmos nela. Isso não acontece com um fluido não-newtoniano, em que certas tentativas de exercer pressão levam a uma mudança na viscosidade do material, dando a impressão de que ele tem algo de “sólido”. Esse comportamento pode ser explicado pelas relações de atração especiais que se configuram quando se tratam de dispersões coloidais, devido ao tamanho das partículas (ou gotículas) presentes nessas estruturas.
#fluido não newtoniano#física#fluidos#mecânica dos fluidos#química#coloides#dispersões#soluções#misturas#homogêneo#partícula
0 notes
Text
Lista de Exercícios N.° 1

Prezados alunos,
Trata-se de uma lista sucinta que envolve questões importantes e representativas sobre assuntos que estão sendo tratados em nossas aulas. Dentro do possível, procuramos trazer problemas das provas mais recentes. Conforme avançamos no conteúdo, entretanto, e os mesmos vão-se tornando mais específicos, maior será a probabilidade de surgirem questões ainda mais atuais.
Bons estudos!
Ex 01 – Unicamp – ácidos e bases / mol | O aquarismo é uma atividade que envolve a criação de espécies aquáticas em ambiente confinado. O bom funcionamento do aquário depende do controle de uma série de parâmetros, como temperatura, matéria orgânica dissolvida, oxigênio dissolvido, pH, entre outros. Para testar seus conhecimentos químicos, responda às seguintes questões:
a) Um dos principais produtos do metabolismo dos peixes é a amônia, que é excretada na água. Desconsiderando-se qualquer mecanismo de regulação externa e considerando-se apenas essa excreção de amônia, o valor do pH da água do aquário tende, com o passar do tempo, a aumentar, diminuir ou permanecer constante? Justifique.
b) Para peixes de água fria, a concentração ideal de gás oxigênio dissolvido na água é de 5 ppm. Considerando-se esse valor e um aquário contendo 250 kg de água, quantos mols de gás oxigênio estão dissolvidos nessa água?
Dados: 1 ppm significa que há 1 grama de gás oxigênio dissolvido em 1.000 quilogramas de água; massa molar do gás oxigênio = 32 g mol”.
Resolução
a) A equação da ionização da amônia dissolvida em água pode ser expressa por:
NH3(aq) + H2O(l) → NH4+(aq) + OH–(aq)
Iremos ter um aumento na concentração de íons OH– na solução, aumentando o pH do meio.
b) Cálculo da massa de O2 que se dissolve em 250 kg de H2O:
1 ppm → 1 g de O2 ––––––– 1.000 kg de H2O
5 ppm → 5 g de O2 –––––– 1.000 kg de H2O
x –––––– 250 kg de H2O
x = 1,25 g
Cálculo da quantidade de matéria (mols) de O2:
32 g ––––––– 1 mol
1,25 g ––––––– y
y = 0,039 mol de O2
Ex 02 – Unicamp – estudo dos gases | Pressão parcial é a pressão que um gás pertencente a uma mistura teria se o mesmo gás ocupasse sozinho todo o volume disponível. Na temperatura ambiente, quando a umidade relativa do ar é de 100%, a pressão parcial de vapor de água vale 3,0x103 Pa . Nesta situação, qual seria a porcentagem de moléculas de água no ar?
a) 100%. b) 97%. c) 33%. d) 3%.
Dados: a pressão atmosférica vale 1,0x105 Pa . Considere que o ar se comporta como um gás ideal.
Resolução (D)
A umidade relativa é a razão entre a pressão parcial de vapor de água do ar e a pressão de vapor nas condições de equilíbrio. Sendo a umidade relativa igual a 100 %, teremos:
1x105 Pa ------------ 100%
3x103 Pa ------------ x x = 3 % (A porcentagem de moléculas de água no ar é de 3%).
Ex 03 – Fuvest – polaridade / forças intermoleculares | Considere os seguintes compostos isoméricos:
CH3CH2CH2CH2OH e CH3CH2OCH2CH3
butanol éter dietílico
Certas propriedades de cada uma dessas substâncias dependem das interações entre as moléculas que a compõem (como, por exemplo, as ligações de hidrogênio). Assim, pode-se concluir que,
a) a uma mesma pressão, o éter dietílico sólido funde a uma temperatura mais alta do que o butanol sólido.
b) a uma mesma temperatura, a viscosidade do éter dietílico líquido é maior do que a do butanol líquido.
c) a uma mesma pressão, o butanol líquido entra em ebulição a uma temperatura mais alta do que o éter dietílico líquido.
d) a uma mesma pressão, massas iguais de butanol e éter dietílico liberam, na combustão, a mesma quantidade de calor.
e) nas mesmas condições, o processo de evaporação do butanol líquido é mais rápido do que o do éter dietílico líquido.
Resolução (C)
As interações intermoleculares no butan-1-ol são mais intensas do que as que ocorrem no éter dietílico, visto que o primeiro faz ligações de hidrogênio, e o último, não. Por esse motivo, a temperatura de ebulição do butan-1-ol, na mesma pressão, é maior do que a do éter dietílico.
Ex 04 – Fuvest – polaridade / forças intermoleculares Um funcionário de uma empresa ficou encarregado de remover resíduos de diferentes polímeros que estavam aderidos a diversas peças. Após alguma investigação, o funcionário classificou as peças em três grupos, conforme o polímero aderido a cada uma. As fórmulas estruturais de cada um desses polímeros são as representadas ao lado.
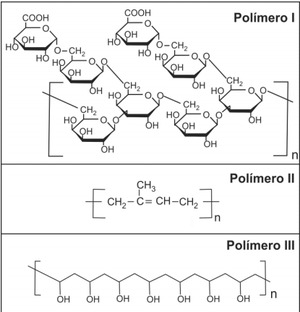
Para remover os resíduos de polímero das peças, o funcionário dispunha de apenas dois solventes: água e n-hexano.
O funcionário analisou as fórmulas estruturais dos três polímeros e procurou fazer a correspondência entre cada polímero e o solvente mais adequado para solubilizá-lo. A alternativa que representa corretamente essa correspondência é:
A I - água; II - n-hexano; III - água.
B I - n-hexano; II - água; III - n-hexano.
C I - n-hexano; II - água; III - água.
D I - água; II - água; III - n-hexano.
E I - água; II - n-hexano; III - n-hexano.
Resolução (A)
Para solubilizar os polímeros I e III o solvente mais adequado seria a água, por se tratar de compostos polares e pela presença de hidroxilas (-OH) em suas estruturas o que favorece a formação de ligações de hidrogênio com a água.
Já o polímero II é um composto apolar logo para solubilizá-lo usa-se um outro composto apolar que neste caso seria o n-hexano.
Ex 04 – Fuvest – ácidos e bases | Um recipiente contém 100 mL de uma solução aquosa de H2SO4 de concentração 0,1 mol/L. Duas placas de platina são inseridas na solução e conectadas a um LED (diodo emissor de luz) e a uma bateria, como representado abaixo.
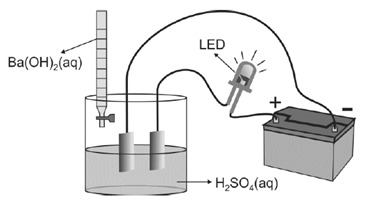
A intensidade da luz emitida pelo LED é proporcional à concentração de íons na solução em que estão inseridas as placas de platina.
Nesse experimento, adicionou-se, gradativamente, uma solução aquosa de Ba(OH)2, de concentração 0,4 mol/L, à solução aquosa de H2SO4, medindo-se a intensidade de luz a cada adição.
Os resultados desse experimento estão representados no gráfico.
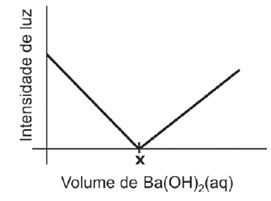
Sabe-se que a reação que ocorre no recipiente produz um composto insolúvel em água.
a) Escreva a equação química que representa essa reação.
b) Explique por que, com a adição de solução aquosa de Ba(OH)2, a intensidade de luz decresce até
um valor mínimo, aumentando a seguir.
c) Determine o volume adicionado da solução aquosa de Ba(OH)2 que corresponde ao ponto x no
gráfico. Mostre os cálculos.
Resolução:
a) Na solução ocorrerá a reação entre o ácido sulfúrico (H2SO4 ) e o hidróxido de bário (Ba(OH)2).
Então:
H2SO4 + Ba(OH)2 –> BaSO4 + 2H2O
b) A luminosidade da lâmpada depende da quantidade de íons em solução. Assim, à medida que a reação vai ocorrendo, o total de íons em solução diminui, o que reduz o brilho da lâmpada.
Contudo, ao adicionar mais Ba(OH)2, haverá um excesso de íons Ba2+ e de íons OH– em solução, o que propiciará um aumento do brilho da lâmpada.
c) Calculando a quantidade de matéria (número de mols de H2SO4):
n = M. V(L) –> n = 0,1 . 0,1 = 0,01 mol de ácido sulfúrico.
Como a reação ocorre na proporção de 1:1 (1 mol de H2SO4 reage com 1 mol de Ba(OH)2), serão necessários 0,01 moles de Ba(OH)2.
Então:
n = M. V(l) –> 0,01 = 0,04 . V –> V = 0,025 L
V = 25 mL
#química#ligações químicas#forças intermoleculares#vestibular#ácidos e bases#mol#lista de exercícios
0 notes
Text
Modelo do Gás Ideal

Para o estudo dos gases, o modelo ideal cabe muito bem por duas razões principais: primeiro, que mesmo na prática faz sentido para pressões relativamente baixas e temperaturas altas; segundo, que simplifica demais os cálculos.
Existe uma área da Química - e da Física - específica para o estudo dos gases porque as substâncias nesse estado físico apresentam características únicas, como uma extrema facilidade de compressão e respostas bastante claras na pressão, além das variações de volume através da temperatura. Aliás, essas três variáveis - a pressão, o volume e a temperatura - são consideradas as três variáveis de estado, importantíssimas no estudo dos gases. Para compreender seu papel, entretanto, é importante compreender como é o modelo por trás das substâncias gasosas, isto é, como os gases, que não podem ser vistos, podem ser estudados através de seu comportamento físico.
Esferas em movimento
Convém imaginar todos os gases, independentemente de suas naturezas químicas, como formados por partículas (as moléculas) que não param de se mover. Elas se movem o tempo todo, limitadas somente pelo recipiente onde estão, atingindo as paredes de vez em quando e não se chocando muito entre si. Quando se chocam, essas colisões são do tipo elástico, isto é, elas só mudam de direção por causa do contato, mas nunca perdem velocidade.
Esse modelo do gás ideal coloca uma perspectiva interessante, porque, a partir dele, o único tipo de energia presente nos gases passa a ser a cinética, isto é, a energia de movimento. Por isso, para um gás real que venha a ser estudado em laboratório, quanto maior a sua temperatura - isto é, quanto maior a velocidade das partículas - mais próximo seu comportamento aproxima-se do “ideal” da teoria, de forma que as fórmulas físicas do gás ideal podem ser usadas tranquilamente nos cálculos. Além disso, para que esse gás real tenha comportamento ideal, também é importante que sua pressão seja relativamente baixa; isso significa que não pode haver uma quantidade muito grande de gás dentro do recipiente.
Para todos os efeitos de vestibular, até hoje, os gases sempre puderam ser considerados ideais. Saber quando aplicar o modelo ideal ou não é um problema dos cientistas, mas não dos vestibulandos!
Uma vez que podemos sempre usar as equações do modelo ideal, basta saber que estamos tratando da equação geral dos gases e da equação de estado dos gases ideais, a serem discutidas em outro artigo.
#gás ideal#modelo do gás ideal#termodinâmica#química#equação geral#equação de estado#estudo dos gases#temperatura#pressão#volume
0 notes
Text
Reações de Neutralização

É bastante seguro afirmar que a neutralização é um clássico dos vestibulares e, também, um tipo de processo bastante fácil de identificar. Ocorrendo entre ácidos e bases, dá origem a sais e a um pouco de água, numa lógica de troca de íons.
Aliás, a troca entre positivos e negativos de duas substâncias também são algo comum na Química. Seja como for, um bom exemplo de neutralização pode ser escrito como:
HCl + NaOH -> NaCl + HOH
Tanto os ácidos quanto as bases (neste caso, o ácido clorídrico e o hidróxido de sódio) liberam íons quando em água. Aliás, é importante lembrar que essas reações só acontecem nessa condição. Os íons positivos vindos do ácido e da base (H+ e Na+ , respectivamente, que estão em negrito) trocam de pares, associando-se aos íons negativos um do outro, para dar um sal (cloreto de sódio, no caso) e água (que foi representada na forma HOH, mas poderia ser H2O também).
Neutralização parcial
Um caso interessante se dá quando um dos reagentes, isto é, o ácido ou a base, têm uma forma que oferece mais íons do que o outro. Por exemplo, em:
HCl + Ca(OH)2 -> Ca(OH)Cl + HOH
a menos que a quantidade de ácido colocada para reagir seja o dobro da de base, ocorrerá uma neutralização parcial, neste caso, da base. Observe que um dos íons OH- saiu para formar a água, mas outro continuou ligado ao cálcio, mantendo-se na formulação final do sal. É fácil compreender isso quando vemos que não havia íons H+ suficientes vindos do ácido para neutralizar a base totalmente. O nome do sal formado é hidroxicloreto de cálcio.
Também pode ocorrer a neutralização parcial do ácido, como no exemplo:
H2SO4 + NaOH -> NaHSO4 + HOH
Continuamos colocando em negrito tudo o que é positivo. Pois bem. Aqui, não havia íons OH- suficientes para neutralizar totalmente o ácido e formar duas moléculas de água. Por isso, somente uma foi formada, e um íon H+ acabou fazendo parte do sal, cujo nome é bissulfato de sódio ou hidrogenossulfato de sódio.
É claro que a coisa muda de figura quando há, disponíveis, maiores quantidades de um reagente do que de outro. No caso da última reação, se fossem colocados para reagir, proporcionalmente, 1 mol de ácido de 2 de base (não se preocupe com os mols, somente se atenha à proporção entre fórmulas) teríamos um processo um pouco diferente:
1 H2SO4 + 2 NaOH -> 1 Na2SO4 + 2 HOH
Observe que a única coisa que mudou da reação anterior para essa, do ponto de vista dos reagentes, são suas quantidades. Antes, todos os coeficientes estequiométricos (em itálico) valiam 1, e não foram representados. Agora, a proporção ácido-base é de 1:2, e haviam íons OH- disponíveis para reagir com os dois íons H+ vindos do ácido, e, portanto, duas moléculas de água foram formadas. O novo sal se chama sulfato de sódio, e tem uma fórmula com aspecto um pouco mais comum.
(imagem do topo: “Fast titration” por “Earl”, em https://www.flickr.com/photos/photobunny_earl/4676248494 , alguns direitos reservados: https://creativecommons.org/licenses/by-nc-nd/2.0/ .)
#química#titulação#neutralização#salificação#ácido#base#vestibular#ensino médio#ciências#reação química#sal#sulfato de sódio#ácido clorídrico#ácido sulfúrico#hidróxido de sódio#bissulfato de sódio#fórmula
1 note
·
View note
Text
Mol e Massa Molar

De uma porção de uma substância qualquer, como é possível saber a quantidade de moléculas (ou de átomos)?
A chamada Massa Molecular (abreviada por MM) nos dá exatamente a massa de uma molécula de uma determinada substância. Isto é, dizer que a massa do dióxido de carbono (CO2) vale 44u significa dizer que essa é a massa desse pequeno conjuntinho de três átomos. Preste atenção, entretanto: a unidade que acompanha esse número é “u“, que é a Unidade de Massa Atômica, muito, mas muito menor do que o nossos grama ou quilograma de todos os dias.
Mol
O conceito de Mol veio justamente para nos ajudar na tarefa de estabelecer uma relação entre as unidades “u” e “gramas”, sem que fosse necessário fazer conversões de unidades recheadas de contas. É simples. O Mol se baseia numa constante – o Número de Avogadro – que vale 6,023×1023 aproximadamente, e que costuma ser utilizado de forma arredondada como 6×1023. Essa constante corresponde à quantidade de partículas presentes na massa, em gramas, numericamente igual à massa molecular de uma determinada substância.
Retomemos o exemplo do gás carbônico. Sua massa molecular vale 44u, certo? Se mantivermos o número – 44 – e trocarmos somente a unidade de u para gramas, teremos a Massa Molar dessa substância: 44g/mol. Escrever a unidade dessa maneira, colocando “por mol”, é importante para reforçar que, agora, estamos falando de uma quantidade de partículas muito maior; não se trata mais de uma molécula só, mas de 6×1023 moléculas dessa substância.
O Número de Avogadro vale para qualquer substância, sempre que esse raciocínio precisar ser aplicado. Isso é possível porque essa constante está sujeita tão somente à relação entre as unidades u e gramas, e não à natureza do material estudado.
De onde veio isso?
A constante de Avogadro não é uma invenção, e sim uma descoberta dentro de uma relação entre unidades. Sua determinação não foi feita de uma vez só, mas num longo processo. As tentativas de se obter esse número passaram por uma infinidade de estimativas, chegaram a ser realizadas por contagem de partículas em estruturas coloidais e, hoje, contam com análises por raios X, que são capazes de determinar o volume das estruturas fundamentais de certas substâncias e que, por isso, permitem que se estabeleça uma relação de quantidade entre essas estruturas e as amostras onde são encontradas.
Como usar?
Um exemplo simples: digamos que você precisa saber a quantidade de moléculas de, digamos, gás hidrogênio (H2) numa certa massa dessa substância, com a intenção de descobrir, depois, a quantidade exata de uma outra que deverá, com ela, reagir. Como exemplo, consideremos que a massa de hidrogênio que temos é de 10g.
De posse desses valores, basta concentrar-se na substância em si – o H2 –, determinando suas massas molecular e, portanto, molar e, finalmente, montar uma proporção que envolva os dados do problema.
A massa molecular do hidrogênio vale 2u, uma vez que cada átomo na molécula tem massa 1u, dado que se obtém na Tabela Periódica. Como 2u é a massa molecular, a massa molar é 2g/mol. Deste último valor, constrói-se uma regra de três como a seguinte:
2g de H2 ——————— 6×1023 moléculas
10g de H2 ——————– x moléculas
A solução dessa proporção leva à quantidade de moléculas na amostra de 10g do gás, que deverá ser 30×1023 ou 3,0×1024 moléculas.
0 notes